 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知(Cu2+/Cu)=0.337V,(Fe3+/Fe2+)=0.771V,(Cl2/Cl-)=1.36V,(/Mn2+)=1.51V,在Cu、Fe2+、Cl-、Mn2+中,还原能力
已知




 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知




 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“已知(Cu2+/Cu)=0.337V,(Fe3+/Fe2+)…”相关的问题
更多“已知(Cu2+/Cu)=0.337V,(Fe3+/Fe2+)…”相关的问题
计算Cu2+的浓度为0.001mol·L-1时,电对Cu2+/Cu的电极电势。已知
电池Zn|Zn2+(c=?)||Cu2+(0.02mol·L-1)|Cu,其电动势为1.06V,计算Zn2+浓度。已知 (Zn2+/Zn)=-0.763V,
(Zn2+/Zn)=-0.763V,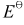 (Cu2+/Cu)=0.337V。
(Cu2+/Cu)=0.337V。
经计算判断反应Zn2+(0.10mol·L-1)+Cu====Zn+Cu2+(2.0mol·L-1)的方向。已知

将一块纯铜片置于0.050mol/L AgNO3溶液中,计算溶液达到平衡后的组成。已知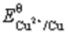 (Cu2+/Cu)=0.337V,
(Cu2+/Cu)=0.337V,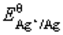 (Ag+/Ag)=0.80V。(提示:首先计算出反应平衡常数。)
(Ag+/Ag)=0.80V。(提示:首先计算出反应平衡常数。)
在0.50mol·L-1H2SO4溶液中,电解0.1000mol·L-1(CuSO4)。溶液,使之开始电解的理论分解电压为多少?(已知E (Cu2+/cu)=0.337V,E
(Cu2+/cu)=0.337V,E (O2/H2O)=1.23V)
(O2/H2O)=1.23V)
电池Ni(s)|NiSO4(0.0250mol·L-1)||KIO3(0.10mol·L-1),Cu(IO3)2(s)|Cu(s)的电动势为0.482V,求Cu(IO3)2的


已知EΘ(Cu2+/Cu)=0.340V,EΘ(Cu+/Cu)=0.521V,则EΘ(Cu2+/Cu+)为()。
A.一0.184V
B.一0.1 59V
C.0.184V
D.0.159V
 (Fe3+/Fe2+)=0.77V,
(Fe3+/Fe2+)=0.77V, (Cu2+/Cu)=0.34V,则反应2Fe3+(1mol·L-1)+Cu====2Fe2+(1mol·L-1)+Cu2+(1mol·L-1)进行的方向是( )。
(Cu2+/Cu)=0.34V,则反应2Fe3+(1mol·L-1)+Cu====2Fe2+(1mol·L-1)+Cu2+(1mol·L-1)进行的方向是( )。A.呈平衡态
B.正向自发进行
C.逆向自发进行
D.无法判断
A.Zn2+浓度
B.Cu2+浓度
C.Zn(s)尺寸
D.Cu(s)尺寸