题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
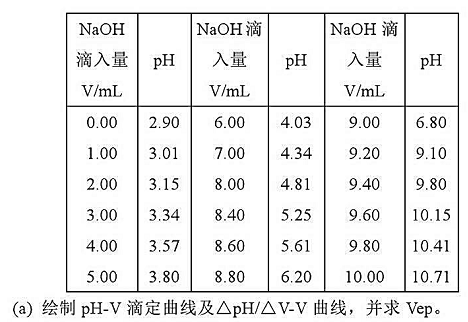
用0.1000mol·L-1NaOH溶液滴定50.00mL一元弱酸的数据如下: 体积/mL pH 0.001.002.004.007.0
用0.1000mol·L-1NaOH溶液滴定50.00mL一元弱酸的数据如下:
(a)绘制滴定曲线;
(b)绘制 曲线;
曲线;
(c)用二级微商法确定终点;
(d)计算试样中弱酸的浓度;
(e)化学计量点的PH应为多少?
(f)计算此弱酸的电离常数(提示:根据滴定曲线上的半中和点的PH)。
| 体积/mL | pH |
| 0.00 1.00 2.00 4.00 7.00 10.00 12.00 14.00 15.00 15.50 15.60 15.70 15.80 16.00 17.00 20.00 24.00 28.00 | 3.40 4.00 4.50 5.05 5.47 5.85 6.11 6.60 7.04 7.70 8.24 9.43 10.03 10.61 11.30 11.96 12.39 12.57 |
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案




 更多“用0.1000mol·L-1NaOH溶液滴定50.00mL一…”相关的问题
更多“用0.1000mol·L-1NaOH溶液滴定50.00mL一…”相关的问题
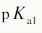 =3.14,
=3.14,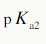 =4.77和
=4.77和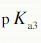 =6.39。若用0.1000mol·L-1NaOH溶液滴定0.1000mol·L-1的柠檬酸溶液,会有几个滴定突跃?应选取何种指示剂?
=6.39。若用0.1000mol·L-1NaOH溶液滴定0.1000mol·L-1的柠檬酸溶液,会有几个滴定突跃?应选取何种指示剂?