 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
某试液中Cu2+和Ag+浓度均为2.0×10-2mol·dm-3,以0.40 mol·dm-3
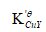 ,若以紫脲酸氨为指示剂(pH=10时,pCut=13.8),计算终点误差。
,若以紫脲酸氨为指示剂(pH=10时,pCut=13.8),计算终点误差。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
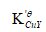 ,若以紫脲酸氨为指示剂(pH=10时,pCut=13.8),计算终点误差。
,若以紫脲酸氨为指示剂(pH=10时,pCut=13.8),计算终点误差。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“某试液中Cu2+和Ag+浓度均为2.0×10-2mol·dm…”相关的问题
更多“某试液中Cu2+和Ag+浓度均为2.0×10-2mol·dm…”相关的问题
某溶液含有Ag+、Pb2+、Ba2+等离子,其浓度均为0.1mol/L,通过计算说明滴加K2CrO4溶液时上述离子开始沉淀的顺序。
取3mL含2mol·L-1NH3的Cu2+试液放入1.00cm厚的吸收池中,在某一确定波长光的照射下,测得吸光度为0.50,然后取1.00mL0.0200mol·L-1CuSO4标准溶液添加到该吸收池中,混匀后测得吸光度为0.65。试求出原试液中Cu2+的浓度?
Ag2CrO4的溶度积(Ks=2.0×10-12)小于AgCl的溶度积(Ksp,AgCl=1.8×10-10),所以在含有相同浓度的CrO42-和试液中滴加AgNO3时,则Ag2CrO4首先沉淀。( )
有一铜锌合金试样,称0.5000g溶解后定容成100.0mL,取25.00mL,调pH=6.0,以PAN为指示剂,用0.05000mol·L-1EDTA滴定Cu2+、Zn2+,用去EDTA 37.30mL。另取25.00mL试液,调pH=10.0,加入KCN,Cu2+、Zn2+被掩蔽,再加甲醛以解蔽Zn2+,消耗相同浓度的EDTA 13.40mL,计算试样中Cu和Zn的质量分数。
A.不可能将Cu2+与Mg2+分离
B.分离很不完全
C.可完全分离
D.无法判断
某试液含有1.000 m?L -1 Cu2+和1.000×10-2mol?L-1Ag+,若以铂电极进行电解,在阴极上首先析出的是铜还是银?两种离子是否可以电解分离?(
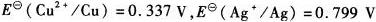 )
)
金属离子Fe2+、Cu2+、Al3+、Mn2+浓度均为0.01mol/L,计算各离子开始沉淀为氢氧化物和沉淀完全的pH。已知 =8.0×10-16,
=8.0×10-16, =2.6×10-19,
=2.6×10-19, =4.6×10-33,
=4.6×10-33, =1.9×10-13。
=1.9×10-13。
将一块纯铜片置于0.050mol/L AgNO3溶液中,计算溶液达到平衡后的组成。已知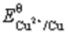 (Cu2+/Cu)=0.337V,
(Cu2+/Cu)=0.337V,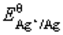 (Ag+/Ag)=0.80V。(提示:首先计算出反应平衡常数。)
(Ag+/Ag)=0.80V。(提示:首先计算出反应平衡常数。)