 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
Cu电极插入含氨1.00mol·L-1和1.00mol·L-1[Cu(NH3)4]2+的混合溶液中
,它和标准氢电极(作正极)组成原电池,测得其电动势E=0.030V.[已知φθ(Cu2+/Cu)=0.342V]
(1)写出电池反应和原电池符号.
(2)计算[Cu(NH2)4]2+的稳定常数KIθ.
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
,它和标准氢电极(作正极)组成原电池,测得其电动势E=0.030V.[已知φθ(Cu2+/Cu)=0.342V]
(1)写出电池反应和原电池符号.
(2)计算[Cu(NH2)4]2+的稳定常数KIθ.
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“Cu电极插入含氨1.00mol·L-1和1.00mol·L-…”相关的问题
更多“Cu电极插入含氨1.00mol·L-1和1.00mol·L-…”相关的问题
电极反应: ,计算电对
,计算电对



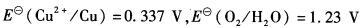 O2在Pt电极上的超电位为0.85 V,Cu的超电位为0 V)
O2在Pt电极上的超电位为0.85 V,Cu的超电位为0 V)
A.Cu2+;
B.Cu(NH3)2+2;
C.Cu(NH3)2+4;
D.三种离子之和。
铜离子选择型电极测定含cu2+、cu(NH3)22+Cu(NH3)4/sub>2+的溶液,测得的活度为______。
A.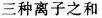
B.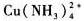
C.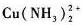
D.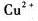
在25℃时,电池“镁离子电极|Mg2+(a=1.8×10-3mol·L-1)‖饱和甘汞电极”的电动势为0.411V,用含Mg2+的试液代替已知溶液,测得电动势为0.439V,试求试液中的pMg。
在1.00mol·L-1的H2SO4溶液中含有Cr2O2-7和MnO-4。用1.00cm比色皿在440nm处测定的吸光度为0.385,在545nm处测定的吸光度为0.653。
在1.004mol·L-1H2SO4溶液中用8.33×10-4mol·L-1Cr2O2-7标准溶液,于440nm处用1.00cm比色皿测定的吸光度为0.308,于545nm处测定的吸光度为0.009;又用1.00cm比色皿测定3.77×10-4mol·L-1的Mn-4标准溶液,440nm处测定的吸光庋为0.035,在545nm处测定的吸光度为0.886。计算Cr2O2-7在440nm处的摩尔吸光系数和MnO-4在545nm处的摩尔吸光系数,同时计算混合液中Cr2O2-7和MnO-4的浓度。
25℃时,电池:(—)NO-3离子电极|NO-3(6.87×10-3mol·L-1)||饱和甘汞电极()的电动势为0.3674V。用含NO-3的试液代替已知浓度的溶液时,测得电池的电动势为0.4464V,求试液中的pNO3值。
以SCE为正极,选择性电极作负极,放入0.001mol·L-1的F-溶液中时,测得E=-0.159V。当换用了含F-试液后,测得E=-0.212V。计算试液中F的浓度。
25℃时,用氯电极测定含盐番茄汁中Cl-含量。取10.0mL番茄汁测得电动势为-17.2mV。若向其中加入0.100mL 0.1000mol·L-1的NaCl溶液,再测得电动势为-35.3mV。计算每升番茄汁中含Cl-的质量(mg)。
酸反应制取Cl2:MnO2(s)+4HCl=Cl2(g)+MnCl2+2H2O.
(1)在标准状态时,能否制取Cl2?
(2)当Mn2+浓度为1.00mol·L-1,Cl2的分压为100kPa时,HCl的浓度至少达到多大时,方可制取Cl2?用计算说明.
(3)按上述反应组成原电池,写出原电池符号.
[Cu(NH3)4]2+溶液等体积混合,有无Cu(OH)2沉淀生成?[已知Cu(OH)2的Kapθ=2.2X10-20]