 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知298K时某一元弱酸的浓度为0.010mol·L-1,测得其pH为4.00,计算Ka和α。已知298K时某一元弱酸的浓度为0.010mol·L-1,测得其pH为4.00,计算Ka和α。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“已知298K时某一元弱酸的浓度为0.010mol·L-1,测…”相关的问题
更多“已知298K时某一元弱酸的浓度为0.010mol·L-1,测…”相关的问题
298K时,1,2-二硝基苯(NB)在水中所形成的饱和溶液的浓度为5.9×10-3mol·dm-3,计算直径为0.01μm的二硝基苯微球在水中的溶解度。已知在该温度下,二硝基苯与水的界面张力 =0.0257N·m-1,二硝基苯的密度为1566kg·m-3,摩尔质量为168g·mol-1。
=0.0257N·m-1,二硝基苯的密度为1566kg·m-3,摩尔质量为168g·mol-1。
某一元弱酸HA在浓度为0.015 mol·L-1时解离度为0.80%,计算当该弱酸浓度为0.10mol·L-1时的解离度。
某一元弱酸HA的浓度为0.010mol·L-1,在常温下测得其pH为4.0。求该一元弱酸的解离平衡常数和解离度。
酸的离解常数Ka。
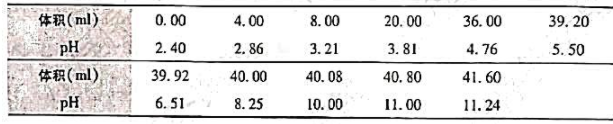
稀油酸钠水溶液的表面张力σ与浓度c之间呈线性关系σ=σ0-bc,式中σ0为纯水表面张力,298K时σ0=0.072N/m,b为常数。实验测得某一浓度时溶液的表面吸附量Γ=4.33×10-6mol/m2,试计算该溶液的表面张力。
298K时,AgCl在水中的饱和浓度为1.27×10-5mol·kg-1,根据Debye-Huckel理论计算反应AgCl====Ag+(aq)+Cl-(aq)的标准Gibbs自由能
在298K时,CO2(g)饱和水溶液的电导率为1.87×10-4S·m-1,已知该温度纯水的电导率为6.0×10-6S·m-1,假定只考虑碳酸的一级解离,并已知该解离常数K1θ=4.31×10-7。试求CO2(g)饱和水溶液的浓度。
298K时,已知 (NaCl)=1.086×10-2S·m2·mol-1,-2(NaOH)=2.172×10-2S·m2·mol-1和
(NaCl)=1.086×10-2S·m2·mol-1,-2(NaOH)=2.172×10-2S·m2·mol-1和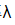 (NH4Cl)=1.298×10-2S·m2·mol-1;NH3·H2O在浓度为0.1mol·dm-3时的摩尔电导率Am=3.09×10-4S·m2·mol-1,浓度为0.01mol·dm-3时的摩尔电导率Am=9.62×10-4S·m2·mol-1。试根据上述数据求NH3·H2O的两种不同浓度溶液的解离度和解离常数。
(NH4Cl)=1.298×10-2S·m2·mol-1;NH3·H2O在浓度为0.1mol·dm-3时的摩尔电导率Am=3.09×10-4S·m2·mol-1,浓度为0.01mol·dm-3时的摩尔电导率Am=9.62×10-4S·m2·mol-1。试根据上述数据求NH3·H2O的两种不同浓度溶液的解离度和解离常数。