 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[单选题]
向原电池(-)Zn│Zn2+(1mol/L)‖Cu2+(1mol/L)│Cu()的正极中加入浓氨水,则该电池的电动势将()。
A.增大
B.减小
C.不变
D.先减小后增大
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A.增大
B.减小
C.不变
D.先减小后增大
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“向原电池(-)Zn│Zn2+(1mol/L)‖Cu2+(1m…”相关的问题
更多“向原电池(-)Zn│Zn2+(1mol/L)‖Cu2+(1m…”相关的问题
在Zn|ZnSO4(1mol·L-1)||CuSO4(1mol·L-1)|Cu原电池中,向ZnSO4溶液中通入NH3后,原电池的电动势将升高。( )
A.增加
B.减少
C.不变
D.无法判断
电池Zn|Zn2+(c=?)||Cu2+(0.02mol·L-1)|Cu,其电动势为1.06V,计算Zn2+浓度。已知 (Zn2+/Zn)=-0.763V,
(Zn2+/Zn)=-0.763V,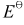 (Cu2+/Cu)=0.337V。
(Cu2+/Cu)=0.337V。
经计算判断反应Zn2+(0.10mol·L-1)+Cu====Zn+Cu2+(2.0mol·L-1)的方向。已知

A.157kJ/mol
B.-157kJ/mol
C.214kJ/mol
D.-214kJ/mol
14.Write the notation for a cell in which the electrode reactions are
2H+(aq)+2e→H2(g)
Zn(s)→Zn2+(aq)+2e
A.[Zn(NH3)4]2+
B.[Zn(en)2]2+
C.[Zn(CN)4]2-
D.[Zn(OH)4]2-
已知 ,试证明当c(Zn2+)=0.001mol·L-1时,锌电极对饱和甘汞电极的电极电位为-1.095V。(φSCE=0.245V)
,试证明当c(Zn2+)=0.001mol·L-1时,锌电极对饱和甘汞电极的电极电位为-1.095V。(φSCE=0.245V)