 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
粗盐提纯过程中,当溶液中只有碳酸根离子和氢氧根离子这两种杂质离子时,也可以应用硫酸或硝酸溶液除去。()
此题为判断题(对,错)。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
此题为判断题(对,错)。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“粗盐提纯过程中,当溶液中只有碳酸根离子和氢氧根离子这两种杂质…”相关的问题
更多“粗盐提纯过程中,当溶液中只有碳酸根离子和氢氧根离子这两种杂质…”相关的问题
A.二氧化碳的实验室制取与性质
B.粗盐的提纯
C.配制一定浓度的溶液,比较不同浓度溶液的某些性质差异
D.收集不同的水样,测定其pH,并用图表或数据等表示实验结果
某硝酸根离子选择性电极的K(NO3-,SO42-=5.80×10-5,现欲在1.00:mol.L-1的硫酸溶液中测定浓度为6.20×10-4mol.L-1的硝酸根离子,试计算电极测定引起的相对误差。
【题目描述】
18.(10分)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
(1)在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl===2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4===2ClO2↑+Na2SO4+O2↑+2H2O

用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是▲。
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子的含量应不超过0.2mg·L-1。
饮用水中CIO2、CIO2的含量可用连续碘量法进行测定。CIO2被I-还原为CIO-2、Cl-的转化率与溶液pH的关系如右图所示。当pH≤2.0时,CIO-2也能被I-完全还原成Cl-。反应生成的I2用标准Na2S2O3溶液滴定: ①请写出pH≤2.0时,CIO-2与I-反应的离子议程式▲。 ②请完成相应的实验步骤: 步骤1:准确量取V mL水样加入到锥形瓶中。 步骤2:调节水样的pH为7.0~8.0。 步骤3:加入足量的KI晶体。 步骤4:加少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。 步骤5:▲。 ③根据上述分析数据,测得该饮用水样中CIO-2的浓度为▲mol·L-1(用含字母的代数式表示。) ④若饮用水中ClO-2的含量超标,可向其中加入适量的Fe2+将ClO-2还原成Cl-, 该反应的氧化产物是▲(填化学式)。
(1)方法二制备的ClO2中不含Cl2

A.Fe3+、Al3+、Mg2+被沉淀而Cu2+、Zn2+、Ca2+存在于溶液中
B.Fe3+、Al3+被定量沉淀,其余四种离子留在溶液中
C.六种离子均被沉淀
D.由于Al3+具有两性,故只有Fe(OH)3沉淀生成
E.Fe3+、Al3+、Cu2+、Zn2+形成沉淀,Ca2+、Mg2+留于溶液中
为什么球状蛋白质在溶液中具有如下性质: (1)在低pH时沉淀。 (2)当离子强度从零增至高值时,先是溶解度增加,然后降低,最后沉淀。 (3)在一定离子强度下,等电点时溶解度降低。
阅读下列三段材料,根据要求完成任务。
材料一《普通高中化学课程标准(实验)》关于“难溶电解质的溶解平衡”的内容标准是:能描述沉淀溶解平衡,知道沉淀转化的本质。
材料二某版本高中实验教科书《化学4》“难溶电解质的溶解平衡”的部分内容:
二、沉淀反应的应用
难溶电解质的溶解平衡也是动态平衡.同样可以通过改变条件使平衡移动——溶液中的离子转化为沉淀,或沉淀转化为溶液中的离子。
1.沉淀的生成
在涉及无机制备、提纯工艺的生产、科研、废水处理等领域中.常利用生成沉淀来达到分离或除去某些离子的目的。例如,工业原料氯化铵中含杂质氯化铁,使其溶解于水,再加入氨水调节pH至7~8,可使Fe3+生成Fe(OH)3沉淀而除去。除调节pH使生成氢氧化物沉淀外,以Na2s、H2s等作沉淀剂,使某些金属离子如Cu2+、Hg2+等,生成极难溶的硫化物CuS、HgS等沉淀,也是分离、除去杂质常用的方法。 .
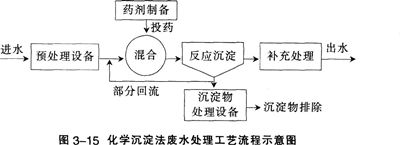
思考与交流
利用生成沉淀分离或除去某种离子,首先要使生成沉淀的反应能够发生:其次希望沉淀生成的反应进行得越完全越好。
1.如果要除去某溶液中的S042-你选择加入钙盐还是钡盐?为什么?
2.以你现有的知识,你认为判断沉淀能否生成可从哪些方面考虑?是否可能使要除去的离子全部通过沉淀除去?说明原因。
材料三教学对象为高中二年级学生,他们已经学习了必修化学1、必修化学2和“化学反应与能量”“化学反应速率和化学平衡”以及“弱电解质的电离”“水的电离和溶液的酸碱度”“盐类的水解”等知识。
要求:
(1)回答材料二中“思考与交流”中的问题。
(2)完成“难溶电解质的溶解平衡”的教学设计,内容包括教学重难点、教学方法和教学过程。