 更多“计算在1mol/LH2SO4介质中用KMnO4溶液滴定Fe2…”相关的问题
更多“计算在1mol/LH2SO4介质中用KMnO4溶液滴定Fe2…”相关的问题
第1题
在1mol/LH2SO4介质中,以Ce4+滴定Fe2+时,最适宜的指示剂为()。A二苯胺磺酸钠B邻二氮菲–亚铁C硝基
在1mol/LH2SO4介质中,以Ce4+滴定Fe2+时,最适宜的指示剂为()。
A二苯胺磺酸钠
B邻二氮菲–亚铁
C硝基邻二氮菲–亚铁
D邻苯氨基苯甲酸
第2题
在1.0mol/LH2SO4介质中用Ce4+滴定Fe2+时,使用二苯胺磺酸钠为指示剂,误差超过0.1%,而加入0.5mol/LH3PO4后,滴
在1.0mol/LH2SO4介质中用Ce4+滴定Fe2+时,使用二苯胺磺酸钠为指示剂,误差超过0.1%,而加入0.5mol/LH3PO4后,滴定终点误差小于0.1%,试说明原因。
第3题
计算在溶液中c()/c(Mn2+)=0.1%,c(H+)=1mol/L时,/Mn2+电对的电极电位。
计算在溶液中c(

第4题
计算在1mol·L-1 HCI溶液中,当[CI-]=1.0mol·L-1时,Ag+/Ag电对的条件电势。
计算在1mol·L-1HCI溶液中,当[CI-]=1.0mol·L-1时,Ag+/Ag电对的条件电势。
点击查看答案
第7题
分别计算在1mol·L-1HCl和1mol·L-1HC1-0.5mol·L-1H3PO4溶液中,
用0.1000mol·L-1K2Cr207滴定20.00mL-10.6000mol·L-1Fe2+时化学计量点的电势。如果在两种情况下都选用二苯胺磺酸钠作指示剂,哪种情况下误差较小?已知在两种条件下,Cr207-/Cr3+的Eθ=1.00V,指示剂的Eθ=0.85V,Fe3+/Fe2+电对在1mol·L-1HCl中的Eθ=0.70V, 而在1mol·L-1HCl-0.5mol·L-1H3PO4中的E”=0.51V.
点击查看答案
第8题
Na2S2O3+H2SO4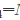 Na2SO4+S↓+SO2↑+H2O在室温下反应,以下4组溶液最先出现浑浊的是()
Na2SO4+S↓+SO2↑+H2O在室温下反应,以下4组溶液最先出现浑浊的是()
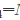 Na2SO4+S↓+SO2↑+H2O在室温下反应,以下4组溶液最先出现浑浊的是()
Na2SO4+S↓+SO2↑+H2O在室温下反应,以下4组溶液最先出现浑浊的是()A.0.1mol/LNa2S2O3和0.1mol/LH2SO4等体积混合
B.0.5 mol/LNa2S2O3和0.5mol/LH2SO4等体积混合
C.1mol/LNa2S2O3和1mol/LH2SO4等体积混合
D.0.5mol/LNa2S2O3和1mol/LH2SO4等体积混合
第10题
已知在1mol/LH2SO4溶液中,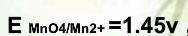 ,
,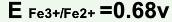 ,在此条件下用KMnO4标准溶液滴定Fe2+,其化学计量点时电位值是( )。
,在此条件下用KMnO4标准溶液滴定Fe2+,其化学计量点时电位值是( )。
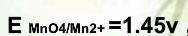 ,
,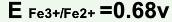 ,在此条件下用KMnO4标准溶液滴定Fe2+,其化学计量点时电位值是( )。
,在此条件下用KMnO4标准溶液滴定Fe2+,其化学计量点时电位值是( )。A.0.77V
B.1.06V
C.1.32V
D.1.45V
第11题
计算在1.5mol·L-1HCl介质中, 当 =0.10mol·L-1 , =0.020mol·L-1时,Cr20
计算在1.5mol·L-1HCl介质中, 当 =0.10mol·L-1, =0.020mol·L-1时,Cr20
点击查看答案
计算在1.5mol·L-1HCl介质中, 当 =0.10mol·L-1,
=0.10mol·L-1, =0.020mol·L-1时,Cr2072-/Cr3+电对的条件电势。
=0.020mol·L-1时,Cr2072-/Cr3+电对的条件电势。

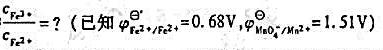

 如果结果不匹配,请
如果结果不匹配,请 
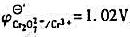 )
)

















