 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
若在1.0L水中溶解0.10mol Zn(OH)2,求需要加入固体NaOH的质量。已知[Zn(OH)4]2-的Kf=1.4×1015,Zn(OH)2的Ksp=1
若在1.0L水中溶解0.10mol Zn(OH)2,求需要加入固体NaOH的质量。已知[Zn(OH)4]2-的Kf=1.4×1015,Zn(OH)2的Ksp=1.2×10-17。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
若在1.0L水中溶解0.10mol Zn(OH)2,求需要加入固体NaOH的质量。已知[Zn(OH)4]2-的Kf=1.4×1015,Zn(OH)2的Ksp=1.2×10-17。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“若在1.0L水中溶解0.10mol Zn(OH)2,求需要加…”相关的问题
更多“若在1.0L水中溶解0.10mol Zn(OH)2,求需要加…”相关的问题
若在1.0L水中溶解0.10molZn(OH)2,需要加人多少克固体NaOH?已知:
Kspθ[Zn(OH)2]=1.2X10-17,Kfθ[Zn(OH)42-]=4.6X1017.
硼砂(Na2B4O7,lOH2O)在水中溶解,并发生如下反应:
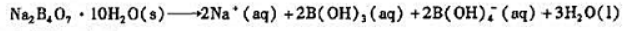
碉酸与水的反应为:

(1)将28.6g硼砂溶解在水中,配制成1.0L溶液,计算溶液的pH;
(2)在(1)的溶液中加入100mL的0.10mol·L-1HCl溶液,其pH又是多少?
蔗糖的水解反应为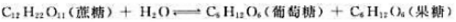
在某温度下,蔗糖的起始浓度为0.20mol·L-1,达到平衡时,蔗糖浓度为0.10mol·L-1.反应的标准平衡常数 在同一温度下,将0.10mol匍萄糖和0.10mol蔗糖混合后配成1.0L溶液,达到平衡时,果糖的浓度
在同一温度下,将0.10mol匍萄糖和0.10mol蔗糖混合后配成1.0L溶液,达到平衡时,果糖的浓度
经计算判断反应Zn2+(0.10mol·L-1)+Cu====Zn+Cu2+(2.0mol·L-1)的方向。已知

的平衡常数.若溶液中NH3和NH4+的浓度均为0.10mol·L-1,则Zn(OH)2溶于该溶液中主要生成哪种配离子?
计算下列溶液的pH
(1)50℃纯水和100℃纯水;
(2)0.20mol·L-1HClO4;
(3)4.0x10-3mol·L-1Ba(OH)2;
(4)将S0mL0.10mol·L-1HI稀释至1.0L;
(5)将100mL2.0x10-3mol·L-1HCl和400mLI.0x10-3mol·L-1HCIO2混合;
(6)混合等体积的0.20mol·L-1HCI和0.10mol·L-1NaOH;
(7)将pH为8.00和10.00的NaOH溶液等体积混合;
(8)将pH为2.00的强酸和pH为13.00的强酸碱溶液等体职混合.