 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
Mn的电势图在极性溶液中为:
MnO4¯0.564MnO42-2.26MnO20.95Mn2O3¯1.51Mn2+-1.18Mn
① 写出可能发生歧化反应的方程式,并配平。
② 写出MnO4¯ 作为氧化剂与Na2SO4在不同PH值下的反应。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
MnO4¯0.564MnO42-2.26MnO20.95Mn2O3¯1.51Mn2+-1.18Mn
① 写出可能发生歧化反应的方程式,并配平。
② 写出MnO4¯ 作为氧化剂与Na2SO4在不同PH值下的反应。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“Mn的电势图在极性溶液中为:”相关的问题
更多“Mn的电势图在极性溶液中为:”相关的问题
5.00×10-5mol·L-1KMnO4溶液在520nm波长处用2.0cm比色皿测得吸光度A=0.224。称取钢样0.500g,溶于酸后,将其中的Mn氧化成MnO4,定容100.00mL后,在上述相同条件下测得吸光度为0.314。求钢样中锰的质量分数。
由附表六中查出酸性溶液中
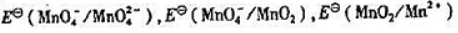
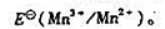
(1)颐出锰元素在酸性溶液中的元素电势图;
(2)计算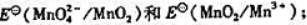
(3)MnO42-能否歧化?写出相应的反应方程式,并计算该反应的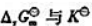 还有哪些物质能歧化?
还有哪些物质能歧化?
(4)计算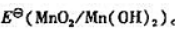
根据教材附表一中的相关数据主考虑电势图N2-HN4+,(aq)-NH;(aq)在酸性溶液中Eθ(N2/HN3)和Eθ(HN3/NH4+).写出HN3(aq)的岐化反应方程,计算25℃下该反应的标准平衡常数Kθ并评价NH3(aq)的稳定性.
酸性溶液中,钒的元素电势图如下:
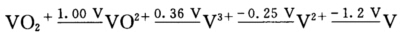 并已知:Eθ(Fe3+/Fe2+)=+0.77 V;Eθ(Zn2+/Zn)=一0.76 V Eθ(Sn2+/Sn)=一0.14 V;Eθ(O2/H2O)=+1.229 V (1)Eθ(VO2+/V2+)________________________________; (2)欲使VO2+→V3+,可选用还原剂________________________________; (3)欲使VO2+→V3+,可选用还原剂________________________________; (4)钒在空气中稳定的形态有________________________________。
并已知:Eθ(Fe3+/Fe2+)=+0.77 V;Eθ(Zn2+/Zn)=一0.76 V Eθ(Sn2+/Sn)=一0.14 V;Eθ(O2/H2O)=+1.229 V (1)Eθ(VO2+/V2+)________________________________; (2)欲使VO2+→V3+,可选用还原剂________________________________; (3)欲使VO2+→V3+,可选用还原剂________________________________; (4)钒在空气中稳定的形态有________________________________。
A.滑动液与本体液之间的电势差
B.小于热力学电位
C.扩散层两侧之间的电势差
D.固体表面与溶液主体间的电势差
E.从微粒表面到切动面之间的电势差
)2沉淀生成.若此NH3·NH4Cl混合溶液中NH3的浓度0.10mol·L-1,则此混合溶液中NH4Cl的浓度至少为多少?
在H2SO4介质中,用0.1000mol·L-1Ce4+溶液滴定0.1000mol·L-1Fe2+时,若选用变色点电势为0.94V的指示剂,终点误差为多少?

的比色皿,在波长520nm处测得吸光度为0.620,高锰酸根离子在波长520nm处的摩尔吸收系数为2.24×103。计算钢样中锰的质量分数。(Ar(Mn)=54.94)