 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
某弱酸HA总浓度为2.0×10-4mol/L。于λ520nm处,用1cm比色皿测定,在不同pH值的缓冲溶液中,测得吸光度值如下:
某弱酸HA总浓度为2.0×10-4mol/L。于λ520nm处,用1cm比色皿测定,在不同pH值的缓冲溶液中,测得吸光度值如下:
| pH | 0.88 | 1.17 | 2.99 | 3.41 | 3.95 | 4.89 | 5.50 |
| A | 0.890 | 0.890 | 0.692 | 0.552 | 0.385 | 0.260 | 0.260 |
求:
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案


 更多“某弱酸HA总浓度为2.0×10-4mol/L。于λ520nm…”相关的问题
更多“某弱酸HA总浓度为2.0×10-4mol/L。于λ520nm…”相关的问题
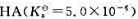 和它的共轭碱NaA组成的缓冲溶液中,HA的浓度为0.25mol·L-1.若在100mL此缓冲溶液中加入5.0mmolNaOH固体,溶液的pH变为5.60。计算加入NaOH固体前缓冲溶液的pH.
和它的共轭碱NaA组成的缓冲溶液中,HA的浓度为0.25mol·L-1.若在100mL此缓冲溶液中加入5.0mmolNaOH固体,溶液的pH变为5.60。计算加入NaOH固体前缓冲溶液的pH. ×10-5C.5×10-9D.2×10-5
×10-5C.5×10-9D.2×10-5

















