 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
用0.5000mol/L的HCl溶液滴定0.5000mol/L一元弱碱B(pKb=6.00),计算化学计量点的pH和滴定突跃范围。若所用溶液
用0.5000mol/L的HCl溶液滴定0.5000mol/L一元弱碱B(pKb=6.00),计算化学计量点的pH和滴定突跃范围。若所用溶液的浓度都是0.0200mol/L,结果又如何?
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
用0.5000mol/L的HCl溶液滴定0.5000mol/L一元弱碱B(pKb=6.00),计算化学计量点的pH和滴定突跃范围。若所用溶液的浓度都是0.0200mol/L,结果又如何?
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“用0.5000mol/L的HCl溶液滴定0.5000mol/…”相关的问题
更多“用0.5000mol/L的HCl溶液滴定0.5000mol/…”相关的问题
将0.5016g石灰石试样溶解于25.00mLc(HCl)=0.5000mol/L盐酸溶液中,剩余的酸用c(NaOH)=0.1000mol/L氢氧化钠溶液返滴定,用去35.40mL,求试样中CaCO3的质量分数。
称取含有杂质的CaO1.500g,溶于40.00mL c(HCl)=0.5000mol/L HCl溶液中,为滴定过量的HCl,用去2.50mL NaOH溶液。若1.00mL HCl相当于1.25mL NaOH溶液,问样品中CaO的质量分数为多少?
含有NaHCO3和Na2CO3以及中性杂质的样品1.200g溶于水后,用15.00mL 0.5000mol·L-1HCl溶液滴定至酚酞终点。继续滴定至甲基橙终点又用去HCl 22.00mL。计算样品中NaHCO3和Na2CO3的质量分数。
用c(
称取1.000g发烟硫酸试样,溶于水后用c(NaOH)=0.5000mol/L氢氧化钠标准滴定溶液滴定,消耗42.82mL,计算试样中H2SO4和SO3的质量分数。
已知H3PO4的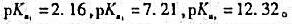 若用0.10mol/L的HCl溶液滴定0.10mol/L的Na3PO4溶液,则滴定到第二个化学计量点时体系的pH=()。
若用0.10mol/L的HCl溶液滴定0.10mol/L的Na3PO4溶液,则滴定到第二个化学计量点时体系的pH=()。
用K2Cr2O7标准滴定溶液在c(HCl)=1mol/L HCl溶液中滴定Fe2+,反应达化学计量点时的电位是1.02V,求此时Fe3+与Fe2+的浓度比。
在0.1mol/L HCl溶液中,用Fe3+滴定Sn2+,其反应为
2Fe3++Sn2+====2Fe2++Sn4+