 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
今有25.00mL KI溶液,用10.00mL0.05000mol/L KIO3溶液处理后,煮沸溶液以除去I2。冷却后,加入过量KI溶液使之与
今有25.00mL KI溶液,用10.00mL0.05000mol/L KIO3溶液处理后,煮沸溶液以除去I2。冷却后,加入过量KI溶液使之与剩余的KIO3反应,然后将溶液调至中性。析出的I2用0.1008mol/L Na2S2O3溶液滴定,用去21.14mL,计算KI溶液的浓度。
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案


 更多“今有25.00mL KI溶液,用10.00mL0.05000…”相关的问题
更多“今有25.00mL KI溶液,用10.00mL0.05000…”相关的问题

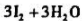 ,析出的碘用Na2S2O3溶液滴定,用去25.10ml。求:Na2S2O3溶液的浓度。(MHNO3=214.0)
,析出的碘用Na2S2O3溶液滴定,用去25.10ml。求:Na2S2O3溶液的浓度。(MHNO3=214.0) =0.01335g/mL]滴定至终点,用去20.64mL,计算试样中Cl的含量。
=0.01335g/mL]滴定至终点,用去20.64mL,计算试样中Cl的含量。
 ±S)的AgNO3溶液滴定,分别消耗AgNO3溶液35.15ml,35.22ml和35.19ml,按偶然误差传递规则计算该氯化物溶液中Cl-的量(mmol/L)。
±S)的AgNO3溶液滴定,分别消耗AgNO3溶液35.15ml,35.22ml和35.19ml,按偶然误差传递规则计算该氯化物溶液中Cl-的量(mmol/L)。
















