 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知下列原电池:(1)写出各电池反应,并分别指出反应方程式中转移的电子数z;(2)计算各电池的标
已知下列原电池:
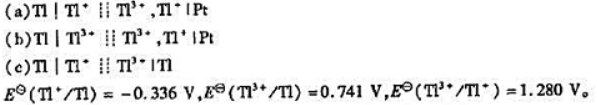
(1)写出各电池反应,并分别指出反应方程式中转移的电子数z;
(2)计算各电池的标准电动势EθMP;
(3)计算各电池反应的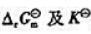 .
.
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知下列原电池:
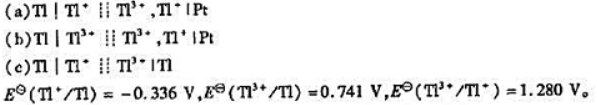
(1)写出各电池反应,并分别指出反应方程式中转移的电子数z;
(2)计算各电池的标准电动势EθMP;
(3)计算各电池反应的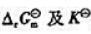 .
.
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“已知下列原电池:(1)写出各电池反应,并分别指出反应方程式中…”相关的问题
更多“已知下列原电池:(1)写出各电池反应,并分别指出反应方程式中…”相关的问题
(1)写出下列各电对的电极反应式,并根据元素电势图给出各电极反应的标准电极电势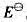 。
。
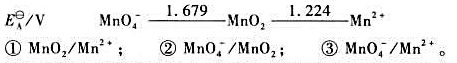
(2)试写出以电对①为负极、电对②为正极的原电池的电池反应,并计算原电池的标准电动势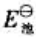 和电池反应的
和电池反应的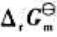 。
。
(3)试写出以电对①为负极、电对③为正极的原电池的电池反应,并计算原电池的标准电动势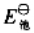 和电池反应的
和电池反应的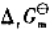 。
。
已知反应
2Cr3++3Cl2+7H2O=Cr2O72-+6C1-+14H+
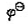 (Cr2O72-/Cr3+)=1.33V,
(Cr2O72-/Cr3+)=1.33V,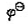 (Cl2/CI-)=1.36V,F=95500J·V-1·mol-2若在298K时组成原电池。
(Cl2/CI-)=1.36V,F=95500J·V-1·mol-2若在298K时组成原电池。
(1)写出该原电监的电池符号,并计算标准电动势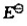 ;(2)计算
;(2)计算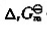 (298K)并判断反应进行的方向;(3)计算标准平衡常数
(298K)并判断反应进行的方向;(3)计算标准平衡常数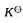 ;(4)若c(H+)=10mol·dm-3,其他离子浓度均为标准浓度,求原电池的电动势E并判断反应进行的方向
;(4)若c(H+)=10mol·dm-3,其他离子浓度均为标准浓度,求原电池的电动势E并判断反应进行的方向
已知

Cd|Cd2+(0.10mol·L-1)||Sn4+(0.10mol·L-1),Sn2+(0.0010mol·L-1)|Pt在298K时的电动势ε,并写出电池反应,标明正、负极。
将反应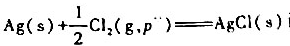 设计成原电池.已知25°C;时,
设计成原电池.已知25°C;时,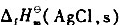 =-127.07kJ.mol-1.
=-127.07kJ.mol-1.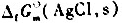 =-109.79kJ.mol-1,标准电极电势
=-109.79kJ.mol-1,标准电极电势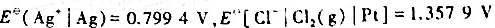 .
.
(1)写出电极反应和电池图示;
(2)求25°C、电池可逆放电2F电荷悬时的热Qz;
(3)求25°C时AgCl的活度积Kap.
现有KNO3和NaNO2的混合样品5.000g,制备成500.0mL的溶液,移液25.00mL,用浓度为0.1200mol·L-1的Ce4+标准溶液50.00mL在强酸中氧化,过量的Ce4+用浓度为0.02500mol·L-1的Fe2+标准溶液滴定,用去Fe2+溶液28.40mL,相应的反应如下:
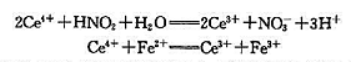
(1)若将第一个反应式作为原电池的电池反应写出该原电池的电极反应并计算该电池反应的ΔrGmθ[已知ϕθ(Ce4++/Ce3+)=1.44V,ϕθ(NO3-/NO2-)=0.934V]
(2)计算试样中NaNO2的质量分数w.[已知M(NaNO2)=69.00g.mol-1]
(3)计算第一步的标准平衡常数Kθ.
解题思路:注意原电池的写法.此题依然是考查电化与热力学、化学平衢间的计算.
298 K下列原电池的电动势为0.328 V时, (一)Pt|H2(pr=1)|H+(mol.L-1)||Cu2+(0.1 mol.L-1)l Cu()
写出原电池的正、负极反应及电池总反应。
(1)写出电池反应方程式;
(2)由附表六查得Eθ(Cl2/Cl-),计算E(Co2+/Co);
(3)p(Cl2)增大时,电池的电动势将如何变化?
(4)当CO2+浓度为0.010mol·L-1其他条件不变时,电池的电动势是多少伏?
有一电池(-)Pt,H2(50kPa)|H+(0.50mol·L-1)||Sn4+(0.70mol·L-1),Sn2+(0.50mol·L-1)|Pt()
(1)写出半反应
(2)写出电池反应
(3)计算原电池的电动势E
(4)当E=0时,在保持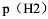 和
和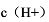 不变的情况下,
不变的情况下,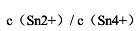 等于多少?
等于多少?
(1)写出原电池符号、电池反应式;
(2)查标准电极电势表,求该原电池的标准电动势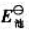 ;
;
(3)当电池反应进行到c(Cu2+)=1.0mol·dm-3时,试计算原电池的电动势E池。