 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
称取纯Fe2O3和Al2O3混合物0.5622g,在加热条件下通氢气使Fe2O3还原为F
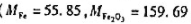
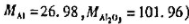
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
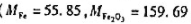
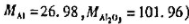
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“称取纯Fe2O3和Al2O3混合物0.5622g,在加热条件…”相关的问题
更多“称取纯Fe2O3和Al2O3混合物0.5622g,在加热条件…”相关的问题
称取只含FeCl3和AlCl3的混合物的质量5.9600g,两种氯化物转变成水合氧化物后,灼烧得到Fe2O3和Al2O3的混合氧化物的质量为2.6300g,计算原混合物中Fe和Al的含量。
,以磺基水杨酸为指示剂。用0.02000mol·L-1EDTA标准溶液滴定试样中的Fe3+。用去18.16ml.然后将试液调至pH=3.5,加入上述EDTA标准溶液25.0mL,并加热煮沸。再调试液pH=4.5.以PAN为指示剂,趁热用CuSO4标准溶液(每毫升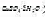 为0.005000g)返滴定,用去8.12mL.计算试样中Fe2O3,和Al2O3,的质量分数。
为0.005000g)返滴定,用去8.12mL.计算试样中Fe2O3,和Al2O3,的质量分数。
用纯CaCO3标定EDTA溶液。称取0.1005g纯CaCO3,溶解后定容到100.00mL。吸取25.00mL,在pH=12.00时,用钙指示剂指示终点,用待标定的EDTA溶液滴定,用去24.50mL。试计算:
(1)EDTA溶液的物质的量浓度(2)该EDTA溶液对ZnO和Fe2O3的滴定度
为分析硅酸岩中铁、铝、钛的含量,称取试样0.6050g。除去SiO2后,用氨水沉淀铁、铝、钛为氢氧化物沉淀。沉淀灼烧为氧化物后的质量为0.4120g;再将沉淀用K2S2O7熔融,浸取液定容于100mL容量瓶,移取25.00mL试液通过锌汞还原器,此时Fe3+还原为Fe2+,Ti4+还原为Ti3+,还原液流入Fe3+溶液中,滴定时消耗了0.01388mol/L K2Cr2O710.05mL;另移取25.00mL试液用SnCl2还原Fe3+后,再用上述K2Cr2O7溶液滴定,消耗了8.02mL。计算试样中Fe2O3、Al2O3、TiO2的质量分数。
称取纯的KCl和KBr的混合样品0.3056g,溶于水后,以K2CrO4为指示剂,用c(AgNO3)=0.1000mol/L的AgNO3标准滴定溶液滴定,终点时用去30.25mL,试求该混合物中KCl和KBr的质量分数。
称取0.5000g黏土样品,用碱熔后分离去SiO2,用容量瓶配成250mL溶液。吸取100mL试液,在pH=2~2.5的热溶液中,用磺基水杨酸作指示剂,用0.02000mol/L的EDTA标准溶液滴定Fe3+,用去7.20mL。滴定Fe3+后的溶液,在pH=3.0时,加入过量的EDTA溶液,再调至pH=4~5.0煮沸,用PAN作指示剂,以CuSO4标准溶液(每毫升含CuSO4·5H2O为0.00500g)滴定至溶液呈紫红色。再加入NH4F煮沸后,又用CuSO4标准溶液滴定,用去CuSO4标准溶液25.20mL。试计算黏土中Fe2O3、Al2O3的质量分数。
测定铁矿中铁的含量时,称取试样0.3029g,使之溶解并将Fe3+还原成Fe2+后,用0.01643mol/L K2Cr2O7溶液滴定耗去35.14mL,计算试样中铁的质量分数。如果用Fe2O3表示,该K2Cr2O7对Fe2O3的滴定度是多少?
试计算Fe2O3(s)+Al(s)-→Al2O3(s)+Fe(s)反应的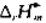 及
及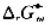 .在298K时,铝箔与Fe2O3有什么样的反应?为什么?实际上在298K时反应又是如何进行?
.在298K时,铝箔与Fe2O3有什么样的反应?为什么?实际上在298K时反应又是如何进行?
称取铁矿石试样0.1562g,试样溶解后,经预处理使铁呈Fe2+状态,用c(