 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知(MnO-4/Mn2+)=1.51V,(Cl2/Cl-)=1.36V,若将此两电对组成原电池,请写出:
已知Eθ(MnO-4/Mn2+)=1.51V,Eθ(Cl2/Cl-)=1.36V,若将此两电对组成原电池,请写出:
(1)该电池的电池符号;
(2)写出正负电极的电极反应和电池反应以及电池标准电动势;
(3)计算电池反应在25℃时和Kθ;
(4)当[H+] = 1.0×10-2mol•L-1,而其他离子浓度均为1.0 mol•L-1,= 100 kPa时的电池电动势.
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案


 更多“已知(MnO-4/Mn2+)=1.51V,(Cl2/Cl-)…”相关的问题
更多“已知(MnO-4/Mn2+)=1.51V,(Cl2/Cl-)…”相关的问题
 (Mn3+/Mn2+)=1.51V,试求:
(Mn3+/Mn2+)=1.51V,试求: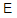 (
(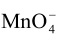 /Mn2+)=1.51V,
/Mn2+)=1.51V, ,计算电对
,计算电对 ,试计算在c(H+)=1.0mol/L,c(
,试计算在c(H+)=1.0mol/L,c(
















