 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
称取干燥Al(OH)3凝胶0.3986g,于250ml量瓶中溶解后,吸取25.00ml,精确加入EDTA标准液(0.0514
0mol/L)25.00ml,过量的EDTA溶液用标准锌溶液(0.04998mo/L)回滴,用去15.02ml,求样品中铝的含量(Al2O3的质量百分含量表示)。(已知MAl2O3=101.96。)
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
0mol/L)25.00ml,过量的EDTA溶液用标准锌溶液(0.04998mo/L)回滴,用去15.02ml,求样品中铝的含量(Al2O3的质量百分含量表示)。(已知MAl2O3=101.96。)
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“称取干燥Al(OH)3凝胶0.3986g,于250ml量瓶中…”相关的问题
更多“称取干燥Al(OH)3凝胶0.3986g,于250ml量瓶中…”相关的问题
样中约含0.1g铝, 先将试样溶解在含有5gNH4Cl的200mL水中,并且加几滴甲基红指示剂(甲基红在pH小于4时显红色,pH大于6时显黄色)。将溶液加热至沸腾,逐滴滴加1:1氨水至指示剂显黄色,得到Al(OH)3沉淀,持续煮沸几分钟后过滤,用热的2%的NH4NO3洗涤.过滤后将沉淀在1000~1100℃灼烧得到Al2O3问:

量好的试样溶解在含有50mL水和10mL6mol·L-1HCl的烧杯中,加入1~2mL浓HNO3将Fe2+氧化为Fe3+, 加热到沸腾除去含氮氧化物后,将溶液稀释到200mL,为了得到Fe(OH)3沉淀,再次将溶液加热至沸腾,慢慢滴加1:1氨水至能够闻到NH的气味,溶液继续保持沸腾数分钟使沉淀沉降在烧杯的底部。过滤,并用热的1%的NH4NO3洗涤沉淀,至洗涤液中不含Cl为止,然后在500~550℃时灼烧沉淀得到称量形式Fe203问:

海水中几种离子的浓度如下:
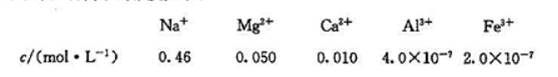
求:(1)c(OH-)浓度多少时,Mg(OH)2开始沉出?已知:K[Mg(OH)2]=5.61X10-12.
(2)在该OH-离子浓度下,是否还有别的离子沉出?已知:K[Al(OH)3]=1.1X10-33,K[Fe(OH)3]=
264X10-39.
用离子一电子法完成并配平下列反应式
(a)酸性介质
(1)KClO3+FeSO4→Fe2(SO4)3+KCI
(2)H2O2+Cr2O72-→Cr3++O2
(3)Na2S2O3+I2→Na2S2O4+NaI
(4)MnO42-→MnO2+MnO4-
(5)As2S3+CIO3-→H2AsO4-+SO42-+Cl-
(b)碱性介质
(1)A1+NO3-→Al(OH)3+NH3
(2)CIO3-+Fe(OH)3→C1-+FeO42-
(3)Fe(OH)2+H2O2→Fe(OH)3
(4)Br2+IO3-→Br+IO4-
(5)S2-+CIO3-→S+CI-
称取只含FeCl3和AlCl3的混合物的质量5.9600g,两种氯化物转变成水合氧化物后,灼烧得到Fe2O3和Al2O3的混合氧化物的质量为2.6300g,计算原混合物中Fe和Al的含量。
称取铝盐试样 1. 2500g ,溶解后加入 0.05000mol/ L 的 EDTA 溶液 25.00mL ,在适当条件下反应后,调节溶液 pH 为 5-6 ,以二甲酷橙为指示剂,用 0. 02000mol/ L 的 Zn2+ 标准溶液回滴过量的 EDTA ,消耗 Zn2+溶液 21. 50mL,计算铝盐中铝的质量分数。 M(Al)= 26. 98
称取铝盐试样1.250g,溶解后加入0.05000mol/L 的EDTA溶液25.00mL,在适当条件下反应后,调节溶液pH为5-6,以甲酚橙为指示剂,用0.02000mol/L的Zn2+标准溶液回滴过量的EDTA,消耗Zn2+溶液21.50mL,计算铝盐中铝的质量分数。M(Al)=26.98g・mol-1。