 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
称取可溶性氯化物试样0.2266g用水溶解后,加入0.1121mol/L AgNO3标准溶液30.00mL。过量的Ag+用0.1185mol/L NH
称取可溶性氯化物试样0.2266g用水溶解后,加入0.1121mol/L AgNO3标准溶液30.00mL。过量的Ag+用0.1185mol/L NH4SCN标准溶液滴定,用去6.50mL,计算试样中氯的质量分数。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
称取可溶性氯化物试样0.2266g用水溶解后,加入0.1121mol/L AgNO3标准溶液30.00mL。过量的Ag+用0.1185mol/L NH4SCN标准溶液滴定,用去6.50mL,计算试样中氯的质量分数。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“称取可溶性氯化物试样0.2266g用水溶解后,加入0.112…”相关的问题
更多“称取可溶性氯化物试样0.2266g用水溶解后,加入0.112…”相关的问题
称取可溶性氯化物样品0.2266g,加入30.00mLc(AgNO3)=0.1121mol/L的AgNO3标准溶液,过量的AgNO3用c(NH4SCN)=0.1185mol/L的NH4SCN标准溶液滴定,用去6.50mL,计算试样中氯的质量分数。
称取氯化物试样0.2266g,加入30.00mL 0.1121mol/L AgNO3溶液。过量的AgNO8消耗了0.1158mol/L NH4SCN 6.50mL。计算试样中氯的质量分数。
称取氯化物试样0.2266g,加入30.00mL 0.1121mol·L-1AgNO3溶液。过量的AgNO3消耗了0.1158 mol·L-1NH4SCN 6.50mL。计算试样中氯的质量分数。已知Cl的摩尔质量为35.45g·mol-1。
将0.1121mol·L-1AgNO3溶液30.00mL,加入含有氯化物试样0.2266g的溶液中,然后用0.1158mol·L-1NH4SCN溶液滴定过量的Ag+,用去NH4SCN溶液0.50mL。计算试样中氯的质量分数。
将0.1121mol·L-1AgNO3溶液30.00mL,加入含有氯化物试样0.2266g的溶液中,然后用0.1158mol·L-1NH4SCN溶液滴定过量的Ag+,用去NH4SCN溶液0.50mL。计算试样中氯的质量分数。
称取不纯的水溶性氯化物(无干扰离子)0.1350g,加入0.1120mol·L-1的AgNO340.00mL,然后用0.1231mol·L-1的NH4SCN 20.50mL完成滴定,计算试样中氯的质量分数。
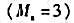
称取Sb2S3试样1.2647g,将其在氧气流中灼烧所产生的SO2气体通入100mL FeCl3溶液中,使Fe3+还原至Fe2+,取该溶液10mL,用c(
称取0.5000g煤试样,灼烧并使其中的硫完全氧化为SO42-。处理成溶液并除去重金属离子后,加入0.05000mol/L的BaCl2溶液20.00mL,使其生成BaSO4沉淀,过量的Ba2+用0.02500mol/L的EDTA标准溶液滴定,用去20.00mL。计算煤中硫的质量分数。