 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
有一标准的Fe3+溶液,浓度为6.00μg·mL-1,在某一波长处其吸光度为0.304,而样品溶液在同一条件下测得吸光度为0
有一标准的Fe3+溶液,浓度为6.00μg·mL-1,在某一波长处其吸光度为0.304,而样品溶液在同一条件下测得吸光度为0.510。求样品溶液中Fe3+溶液的浓度(mg·L-1)。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
有一标准的Fe3+溶液,浓度为6.00μg·mL-1,在某一波长处其吸光度为0.304,而样品溶液在同一条件下测得吸光度为0.510。求样品溶液中Fe3+溶液的浓度(mg·L-1)。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“有一标准的Fe3+溶液,浓度为6.00μg·mL-1,在某一…”相关的问题
更多“有一标准的Fe3+溶液,浓度为6.00μg·mL-1,在某一…”相关的问题
有2.50×10-3mol·dm-3Fe3+溶液与同浓度的SCN-溶液,按不同体积混合成总体积为10.00cm3的溶液,在480nm波长处,用1.00cm吸收池测量吸光度,所有数据列于下表:
V(Fe3+)/cm3 | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 | 7.00 | 8.00 | 9.00 | 10.00 |
V(SCN-)/cm3 | 10.00 | 9.00 | 8.00 | 7.00 | 6.00 | 5.00 | 4.00 | 3.00 | 2.00 | 1.00 | 0.00 |
A | 0.000 | 0.222 | 0.447 | 0.579 | 0.659 | 0.690 | 0.649 | 0.572 | 0.442 | 0.222 | 0.002 |
用K2Cr2O7标准滴定溶液在c(HCl)=1mol/L HCl溶液中滴定Fe2+,反应达化学计量点时的电位是1.02V,求此时Fe3+与Fe2+的浓度比。
于0.100mol/LFe3+和0.250mol/LHCl混合溶液中,通入H2S气体使之达到平衡,求此时溶液中Fe3+的浓度。已知H2S饱和溶液的浓度为0.100mol/L;φ0(S/H2S)=0.141V;φ0(Fe3+/Fe2+)=0.71V。
用2×10-2mol/L EDTA滴定同浓度的Fe3+溶液,若要求△pM'=±0.2、TE=±0.1%,计算滴定的适宜酸度范围。[已知:lgKFeY为25.1,Fe(OH)3的Ksp=10-37.4]
,用硝酸溶解后,用蒸馏水稀释成250mL。移取50.00mL试样溶液,用焦磷酸盐掩蔽Fe3+和Cr3+,达到终点消耗浓度为0.05831mol·L-1的EDTA溶液26.14mL。然后再取出50.00mL试样溶液用六亚甲基四胺处理以掩蔽Cr3+,此时用浓度为0.05831mol·L-1的EDTA溶液滴定,到达终点需要35.443mL。再移取50.00mL原溶液,用50.00mL0.05831mol·L-1的EDTA溶液处理后,返滴定用去浓度为0.06316mol·L-1的Cu2+溶液6.21ml。求合金试样中上述各成分的含量。
向0.10mol·dm-3草酸溶液中滴加NaOH溶液至pH=6.00,试求溶液中H2C2O4,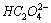 和
和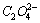 的浓度。已知H2C2O4的K1=5.4×10-2,K2=5.4×10-5。
的浓度。已知H2C2O4的K1=5.4×10-2,K2=5.4×10-5。
测定某试液中Fe2+、Fe3+的含量。吸取25.00mL该试液,在pH=10时用浓度为0.01500mol/L的EDTA标准溶液滴定,耗用15.40mL,调至pH=6,继续滴定,又耗用溶液体积14.10mL,计算两者的浓度(以mg/mL表示)。
在用配位滴定法连续测定溶液中的Al3+、Fe3+时,取50mL试液,用缓冲溶液控制其pH=2.0,以水杨酸为指示剂,用0.04016mol/L的EDTA标准溶液滴定,直到Fe3+-水杨酸配位化合物的红色刚刚消失,共用去EDTA标准溶液29.61mL。再准确称取50.00mL相同浓度的EDTA至溶液中,煮沸使Al3+完全配位,将pH调到5.0。此时用0.03228mol/L Fe3+标准溶液19.03mL返滴定剩余的EDTA,终点的颜色与上面曾出现的Fe3+-水杨酸配位化合物的红色一致。计算原试液中Al3+、Fe3+的浓度。
用0.5000mol/L的HCl溶液滴定0.5000mol/L一元弱碱B(pKb=6.00),计算化学计量点的pH和滴定突跃范围。若所用溶液的浓度都是0.0200mol/L,结果又如何?