 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
在1mol/L HCl溶液中,用Fe3+滴定Sn2-,计算下列滴定百分数时的电位:9%、50%、91%、99%、99.9%、100%、100.1%、101%、1
在1mol/L HCl溶液中,用Fe3+滴定Sn2-,计算下列滴定百分数时的电位:9%、50%、91%、99%、99.9%、100%、100.1%、101%、110%、200%。
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
在1mol/L HCl溶液中,用Fe3+滴定Sn2-,计算下列滴定百分数时的电位:9%、50%、91%、99%、99.9%、100%、100.1%、101%、110%、200%。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“在1mol/L HCl溶液中,用Fe3+滴定Sn2-,计算下…”相关的问题
更多“在1mol/L HCl溶液中,用Fe3+滴定Sn2-,计算下…”相关的问题
用K2Cr2O7标准滴定溶液在c(HCl)=1mol/L HCl溶液中滴定Fe2+,反应达化学计量点时的电位是1.02V,求此时Fe3+与Fe2+的浓度比。
在0.1mol/L HCl溶液中,用Fe3+滴定Sn2+,其反应为
2Fe3++Sn2+====2Fe2++Sn4+
已知在1mol/L HCl介质中,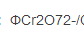 /Cr3+)=1.00V,
/Cr3+)=1.00V,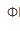 (Fe3+/Fe2+)=0.68V,以K7Cr2O7滴定Fe2+时,适宜的指示剂为( )。
(Fe3+/Fe2+)=0.68V,以K7Cr2O7滴定Fe2+时,适宜的指示剂为( )。
A.自身作指示剂 B.邻苯氨基苯甲酸(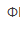 =0.89V)
=0.89V)
C.亚甲基蓝(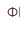 =0.52V)D.邻二氮菲亚铁(
=0.52V)D.邻二氮菲亚铁(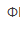 =1.06V)
=1.06V)
A.0.1mol/L HCl
B.1mol/L NH3·H2O
C.1mol/L HAc
D.1mol/L HAc+1mol/L NaAc
E.1mol/L NH3·H2O+1mol/L NH4Cl
A.加水
B.加NaAc
C.加NaOH
D.加0.1mol/L HCl
E.加0.1mol/L H2SO4
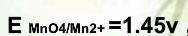 ,
,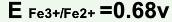 ,在此条件下用KMnO4标准溶液滴定Fe2+,其化学计量点时电位值是( )。
,在此条件下用KMnO4标准溶液滴定Fe2+,其化学计量点时电位值是( )。A.0.77V
B.1.06V
C.1.32V
D.1.45V
计算1mol/L HCl溶液中c(Ce4+)=1.00×10-2mol/L,c(Ce3+)=1.00×10-3mol/L时电对的电位。
A.0.73V
B.0.89V
C.1.32V
D.1.49V