 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[单选题]
已知在1mol/LH2SO4溶液中,
已知在1mol/LH2SO4溶液中,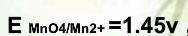 ,
,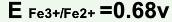 ,在此条件下用KMnO4标准溶液滴定Fe2+,其化学计量点时电位值是( )。
,在此条件下用KMnO4标准溶液滴定Fe2+,其化学计量点时电位值是( )。
A.0.77V
B.1.06V
C.1.32V
D.1.45V
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
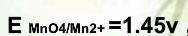 ,
,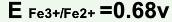 ,在此条件下用KMnO4标准溶液滴定Fe2+,其化学计量点时电位值是( )。
,在此条件下用KMnO4标准溶液滴定Fe2+,其化学计量点时电位值是( )。A.0.77V
B.1.06V
C.1.32V
D.1.45V
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“已知在1mol/LH2SO4溶液中,(/Mn2+)=1.45…”相关的问题
更多“已知在1mol/LH2SO4溶液中,(/Mn2+)=1.45…”相关的问题
A.0.73V
B.0.89V
C.1.32V
D.1.49V
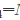 Na2SO4+S↓+SO2↑+H2O在室温下反应,以下4组溶液最先出现浑浊的是()
Na2SO4+S↓+SO2↑+H2O在室温下反应,以下4组溶液最先出现浑浊的是()A.0.1mol/LNa2S2O3和0.1mol/LH2SO4等体积混合
B.0.5 mol/LNa2S2O3和0.5mol/LH2SO4等体积混合
C.1mol/LNa2S2O3和1mol/LH2SO4等体积混合
D.0.5mol/LNa2S2O3和1mol/LH2SO4等体积混合
在1mol/LH2SO4介质中,以Ce4+滴定Fe2+时,最适宜的指示剂为()。
A二苯胺磺酸钠
B邻二氮菲–亚铁
C硝基邻二氮菲–亚铁
D邻苯氨基苯甲酸
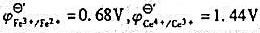 )
)
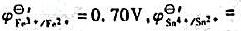 0.14V)
0.14V)
A.c(Fe3+)<1mol·L-1
B.c(Fe2+)<1mol·L-1
C.c(Fe3+)/c(Fe2+)>1
D.c(Fe3+)/c(Fe2+)<1
计算在1mol·L-1HCl溶液中,下述反应的条件平衡常数:
2Fe3++3I-====2Fe2++
当20mL0.10mol·L-1Fe3+与20mL0.30mol·L-1I-混合后,溶液中残留的Fe3+还有百分之几?如何才能做到定量地测定Fe3+?(已知:
