 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[单选题]
将的氢电极与标准氢电极组成一原电池,则原电池的电动势为().A、0.414V B、-0.414V C、0 D、0.8
A.0.414V
B.-0.414V
C.0
D.0.828V
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A.0.414V
B.-0.414V
C.0
D.0.828V
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“将的氢电极与标准氢电极组成一原电池,则原电池的电动势为().…”相关的问题
更多“将的氢电极与标准氢电极组成一原电池,则原电池的电动势为().…”相关的问题
用标准甘汞电极作正极,氢电极作负极(pH2=100kPa)与待测的HCl溶液组成电池。在25℃时,测得E=0.342V。当待测溶液为NaOH溶液时,测得E=1.050V。取此NaOH溶液20.00mL,用上述HCl溶液中和完全,需用HCl溶液多少毫升?
称取2.000 g一元酸HA(相对分子质量为120)溶于50.00 mL水中,用0.200 0 mol.L-1NaOH溶液滴定,用标准甘汞电极(NCE)作正极,氢电极作负极,当酸被中和一半时,在30℃下测得E=0.583 V,完全中和时,E=0.823 V,计算试样中HA的质量分数。(30℃时RT/F=0.060)
A.(Fe3+/Fe2+)
B.(Fe3+/Fe2+)+
C.(Fe3+/Fe2+)+0.05916V
D.(Fe3+/Fe2+)-0.05916V
在含有1.000 mol?L-1硫酸锌与1.000 mol?L-1硫酸镉的1.0 mol?L-1的硫酸介质中,进行电解实验。
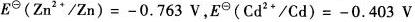 试计算:(1)电解时,锌和镉何者先析出? (2)能否在实验中完全分离锌和镉? (3)在铂和汞电极上,氢的析出是否干扰锌和镉的析出?(已知在铂和汞电极上的ηH2分别为一0.2 V和一1.0 V,ηZn和ηcd均为零)。
试计算:(1)电解时,锌和镉何者先析出? (2)能否在实验中完全分离锌和镉? (3)在铂和汞电极上,氢的析出是否干扰锌和镉的析出?(已知在铂和汞电极上的ηH2分别为一0.2 V和一1.0 V,ηZn和ηcd均为零)。