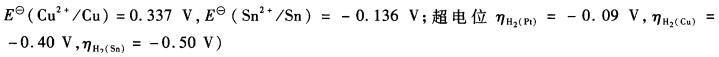题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
用电解方法分离浓度均为8.00×10-2mol?L -1 Zn2+和Ni2+的混合溶液。试问 (1)哪一离子先析出?阴极
用电解方法分离浓度均为8.00×10-2mol?L -1 Zn2+和Ni2+的混合溶液。试问 (1)哪一离子先析出?阴极电位应维持在什么范围内,才可能使这两金属离子分离[vs.SHE(与标准氢电极相比)]? (2)要达到定量分离,阴极电位应维持在什么范围(vs.SHE)?(已知
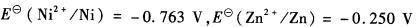 )
)
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
用电解方法分离浓度均为8.00×10-2mol?L -1 Zn2+和Ni2+的混合溶液。试问 (1)哪一离子先析出?阴极电位应维持在什么范围内,才可能使这两金属离子分离[vs.SHE(与标准氢电极相比)]? (2)要达到定量分离,阴极电位应维持在什么范围(vs.SHE)?(已知
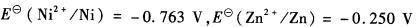 )
)
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“用电解方法分离浓度均为8.00×10-2mol?L -1 Z…”相关的问题
更多“用电解方法分离浓度均为8.00×10-2mol?L -1 Z…”相关的问题
在298K和标准压力下,用电解沉积法分离Cd2+、Zn2+混合溶液。已知Cd2+和Zn2+的浓度均为0.10 mol·kg-1(设活度因子均为1),H2(g)在Cd(s)和Zn(s)上的超电势分别为0.48 V和0.70V,设电解液的pH值保持为7.0。试问:(1)阴极上首先析出何种金属? (2)第二种金属析出时第一种析出的离子的残留浓度为多少?(3)氢气是否有可能析出而影响分离效果?
某溶液中含有Ca2+、Ba2+,其浓度均为0.1mol·L-1,缓慢加入Na2SO4,开始生成的是何沉淀?开始沉淀时
某溶液中含有Ca2+、Ba2+,其浓度均为0.1mol·L-1,缓慢加入Na2SO4,开始生成的是何沉淀?开始沉淀时
用控制电位法分离Pb2+和Ni2+混合溶液中的Pb2+,试求: (1)若起始浓度[Pb2+]=[Ni2+]=0.100 0 mol?L-1,要使Pb2+沉积析出,阴极电位应控制在什么范围(vs.SHE)? (2)在(1)中所选定的电位上,计算残留在溶液中未被电解的Pb2+的分数为多少? (3)在(1)中所选定的电位上,要使30 mL混合试样中的Pb2+完全沉积析出,需要通入电量为多少库仑?
A.不可能将Cu2+与Mg2+分离
B.分离很不完全
C.可完全分离
D.无法判断
下列各酸的浓度均为0.1 mol·L-1,不能用0.1 mol·L-1的NaOH直接滴定的是()。
A.甲酸(Ka=1.77×10-4)
B.氢氰酸(Ka=4.93×10-10)
C.酒石酸(Ka=1.04×10-3)
D.草酸(Ka=5.90×10-2)
E.醋酸(Ka=1.76×10-5)
已知Eθ(MnO-4/Mn2+)=1.51V,Eθ(Cl2/Cl-)=1.36V,若将此两电对组成原电池,请写出:
(1)该电池的电池符号;
(2)写出正负电极的电极反应和电池反应以及电池标准电动势;
(3)计算电池反应在25℃时和Kθ;
(4)当[H+] = 1.0×10-2mol•L-1,而其他离子浓度均为1.0 mol•L-1,= 100 kPa时的电池电动势.
A.交联葡聚糖凝胶(G-75)G表示凝胶的交联程度、膨胀程度及分离范围,75表示凝胶得水值
B.色谱柱内不能有气泡存在,一旦发现有气泡,必须重装
C.用300 mL物质的量浓度为20 mmol/L的磷酸缓冲液充分洗涤平衡凝胶12 h
D.凝胶用自来水充分溶胀后,配成凝胶悬浮液
在0.10 mol?L-1HCIO4溶液中,以铂电极为阴极,电解1.000×10-2 mol?L-1 Cu2+和1.000×10-2mol?L-1Sn2+的混合溶液。试指出在阴极上离子的析出顺序。(已知