 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
在酸性溶液中的半反应为,试计算在c(H+)=1.0mol/L,c()=0.10mol/L,c(Mn2+)=0.00010mol/L时,该电对的电极电位。

 ,试计算在c(H+)=1.0mol/L,c(
,试计算在c(H+)=1.0mol/L,c(


查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)

 ,试计算在c(H+)=1.0mol/L,c(
,试计算在c(H+)=1.0mol/L,c(


 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“在酸性溶液中的半反应为,试计算在c(H+)=1.0mol/L…”相关的问题
更多“在酸性溶液中的半反应为,试计算在c(H+)=1.0mol/L…”相关的问题


已知c(
A.r03-+6H﹢﹢5e==l/2Br2+3H20
B.r03-+6H+6e==Br-+3H2O
C.r03-+3H20+6e==Br-+6OH﹣
D.r03-+6H﹢+e==Br-+3H20
计算在溶液中c(

A.放电时,Pb作为电池的负极发生还原反应
B.放电时,内电路中的H+ 向Pb电极移动
C.充电时,外接电源的负极需要与Pb电极相连
D.充电时,阳极区附近溶液酸性减弱
向酸性的1.0×10-3mol·dm-3Fe3+溶液中加入过量液态汞,发生反应为:

292.15K时,丁酸水溶液的表面张力σ和浓度之间的关系可以用下式表示:
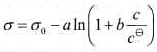 式中σ0为纯水的表面张力,a和b皆为常数。
式中σ0为纯水的表面张力,a和b皆为常数。
(1)写出丁酸溶液在浓度极稀时表面吸附量r与浓度c的关系;
(2)若已知a=13.1x10-3N/m,b=19.62,试计算当c=0.200mol/L时的表面吸附量;
(3)求丁酸在溶液表面的饱和吸附量In:
(4)假定饱和吸附时表面上丁酸成单分子层吸附,计算在液面上每个丁酸分子的横截面积。
在生理温度37℃时,Kw=2.4×10-14。计算在该温度下水的中性点的pH值,此时H+和OH-的浓度相等?