 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
计算在溶液中c()/c(Mn2+)=0.1%,c(H+)=1mol/L时,/Mn2+电对的电极电位。
计算在溶液中c(

查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
计算在溶液中c(

 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“计算在溶液中c()/c(Mn2+)=0.1%,c(H+)=1…”相关的问题
更多“计算在溶液中c()/c(Mn2+)=0.1%,c(H+)=1…”相关的问题

 ,试计算在c(H+)=1.0mol/L,c(
,试计算在c(H+)=1.0mol/L,c(




已知c(
计算在pH=10.0,c(NH3)=0.1mol·dm-3的溶液中Zn2+/Zn电对的条件电极电势(忽略离子强度的影响)。已知锌氨配离子的各级累积稳定常数为:lgβ1=2.27,lgβ2=4.61,lgβ3=7.01,lgβ4=9.06。
计算在1moldm-3NH3·H2O溶液体系中,当 1.00×10mol*-3dm-3时的
1.00×10mol*-3dm-3时的 为多少?[已知
为多少?[已知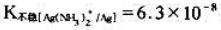 ]
]
在HgCl2=HgCl++Cl-体系中,已知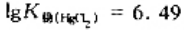 ,请计算在0.01mol·dm-3升汞溶液中的电离度及[HgCl+]/[HgCl2]的比值.
,请计算在0.01mol·dm-3升汞溶液中的电离度及[HgCl+]/[HgCl2]的比值.
计算在pH=5.00的0.10mol·dm-3AlY溶液中,游离F-离子浓度为0.010mol·dm-3时AlY的条件稳定常数。
计算在1mol·L-1HCl溶液中,下述反应的条件平衡常数:
2Fe3++3I-====2Fe2++
当20mL0.10mol·L-1Fe3+与20mL0.30mol·L-1I-混合后,溶液中残留的Fe3+还有百分之几?如何才能做到定量地测定Fe3+?(已知:
