 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
称取一不纯有机一元弱酸试样2.3070g,其纯度为49.00%。将其溶于50.00ml水中,在25℃时,用0.2000mol
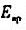 =0.82V。假设滴定过程中体积不变,求该有机酸的摩尔质量。
=0.82V。假设滴定过程中体积不变,求该有机酸的摩尔质量。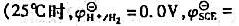
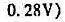
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
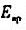 =0.82V。假设滴定过程中体积不变,求该有机酸的摩尔质量。
=0.82V。假设滴定过程中体积不变,求该有机酸的摩尔质量。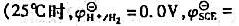
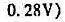
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“称取一不纯有机一元弱酸试样2.3070g,其纯度为49.00…”相关的问题
更多“称取一不纯有机一元弱酸试样2.3070g,其纯度为49.00…”相关的问题
分析不纯的碳酸钙试样(其中不含干扰物质),称取试样0.3000g,加入c(HCl)=0.2500mol/L的HCl标准溶液25.00mL,煮沸除去CO2,用c(NaOH)=0.2012mol/L的NaOH溶液返滴定过量的HCl溶液,消耗NaOH溶液5.84mL,计算试样中CaCO3的质量分数。
分析不纯的碳酸钙(不含干扰物质),称取试样0.3000g,加入浓度为0.2500mol/L的HCl标准溶液25.00mL,煮沸除去CO2,用0.2012mol/L的NaOH溶液返滴定过量的HCl溶液,消耗NaOH溶液5.84mL,计算试样中CaCO3的质量分数。
称取不纯的水溶性氯化物(无干扰离子)0.1350g,加入0.1120mol·L-1的AgNO340.00mL,然后用0.1231mol·L-1的NH4SCN 20.50mL完成滴定,计算试样中氯的质量分数。
称取某有机试样0.1084g测定其中的含磷量。将试样处理成溶液,并将其中的磷氧化成 ,加入其他试剂使之形成MgNH4PO4沉淀。沉淀经过滤洗涤后,再溶解于盐酸中并用NH3-NH4Cl缓冲溶液调至pH=10,以EBT为指示剂,需用0.01004mol/L的EDTA标准溶液21.04mL滴定至终点,计算试样中磷的质量分数。
,加入其他试剂使之形成MgNH4PO4沉淀。沉淀经过滤洗涤后,再溶解于盐酸中并用NH3-NH4Cl缓冲溶液调至pH=10,以EBT为指示剂,需用0.01004mol/L的EDTA标准溶液21.04mL滴定至终点,计算试样中磷的质量分数。
用0.1000mol·L-1NaOH溶液滴定50.00mL一元弱酸的数据如下:
(a)绘制滴定曲线;
(b)绘制 曲线;
曲线;
(c)用二级微商法确定终点;
(d)计算试样中弱酸的浓度;
(e)化学计量点的PH应为多少?
(f)计算此弱酸的电离常数(提示:根据滴定曲线上的半中和点的PH)。
| 体积/mL | pH |
| 0.00 1.00 2.00 4.00 7.00 10.00 12.00 14.00 15.00 15.50 15.60 15.70 15.80 16.00 17.00 20.00 24.00 28.00 | 3.40 4.00 4.50 5.05 5.47 5.85 6.11 6.60 7.04 7.70 8.24 9.43 10.03 10.61 11.30 11.96 12.39 12.57 |
有一含Na2CO3与NaOH的混合物。现称取试样0.5895g,溶于水中,用0.3000mol/L HCI滴定至酚酞变色时,用去HCl 24.08mL;加甲基橙后继续用HCl滴定,又消耗HCl 12.02mL。试计算试样中Na2CO3与NaOH的质量分数。
A.乙
B.均合理
C.甲
D.均不合理
有一铜锌合金试样,称0.5000g溶解后定容成100.0mL,取25.00mL,调pH=6.0,以PAN为指示剂,用0.05000mol·L-1EDTA滴定Cu2+、Zn2+,用去EDTA 37.30mL。另取25.00mL试液,调pH=10.0,加入KCN,Cu2+、Zn2+被掩蔽,再加甲醛以解蔽Zn2+,消耗相同浓度的EDTA 13.40mL,计算试样中Cu和Zn的质量分数。