 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
计算在1mol·L-1HCl溶液中,用Fe3+滴定Sn2+时,化学计量点的电势,并计算滴定至99.9%和100.1%时的电势。说明为什
计算在1mol·L-1HCl溶液中,用Fe3+滴定Sn2+时,化学计量点的电势,并计算滴定至99.9%和100.1%时的电势。说明为什么化学计量点前后,同样改变0.1%,电势的变化不相同。若用电位滴定判断终点,与计算所得化学计量点电势一致吗?(

 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
计算在1mol·L-1HCl溶液中,用Fe3+滴定Sn2+时,化学计量点的电势,并计算滴定至99.9%和100.1%时的电势。说明为什么化学计量点前后,同样改变0.1%,电势的变化不相同。若用电位滴定判断终点,与计算所得化学计量点电势一致吗?(

 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“计算在1mol·L-1HCl溶液中,用Fe3+滴定Sn2+时…”相关的问题
更多“计算在1mol·L-1HCl溶液中,用Fe3+滴定Sn2+时…”相关的问题
计算在1mol·L-1HCl溶液中,用Fe3+滴定Sn2+时化学计量点的电势,并计算滴定至99.9%和100.1%时的电势。说明为什么化学计量点前后,同样改变0.1%,电势的变化不相同。若用电势滴定判断终点,与计算所得化学计量点电势一致吗?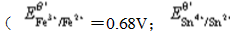
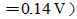
计算在溶液中c(

计算在1.5mol·L-1HCl介质中, 当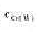 =0.10mol·L-1,
=0.10mol·L-1,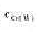 =0.020mol·L-1时,Cr2072-/Cr3+电对的条件电势。
=0.020mol·L-1时,Cr2072-/Cr3+电对的条件电势。
用K2Cr2O7标准滴定溶液在c(HCl)=1mol/L HCl溶液中滴定Fe2+,反应达化学计量点时的电位是1.02V,求此时Fe3+与Fe2+的浓度比。
用镍阴极电解氢氧化钠溶液,在过电位为0.148V、0.394V下相应的电流密度分别为0.0001A·cm-2、0.01A·cm-2,计算在上述介质中析氢反应的传递系数和交换电流密度。
称取烧碱试样2.6830g,加水溶解,转入250mL的容量瓶中定容。吸取25.00mL该溶液,用0.09918mol·L-1HCl溶液滴定至终点,用去盐酸20.32mL,计算试样中氢氧化钠的质量分数。已知氢氧化钠的摩尔质量为40.00g·mol-1。
计算在1moldm-3NH3·H2O溶液体系中,当 1.00×10mol*-3dm-3时的
1.00×10mol*-3dm-3时的 为多少?[已知
为多少?[已知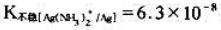 ]
]