 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知=1.51V,在酸性条件下,该电对的条件电势与pH值之间的关系式是什么?(忽略离子强度的影响)
已知
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“已知=1.51V,在酸性条件下,该电对的条件电势与pH值之间…”相关的问题
更多“已知=1.51V,在酸性条件下,该电对的条件电势与pH值之间…”相关的问题

 ,试计算在c(H+)=1.0mol/L,c(
,试计算在c(H+)=1.0mol/L,c(


电极反应: ,计算电对
,计算电对



已知


已知





已知c(
已知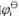 =1.51V,
=1.51V,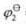 =-0.1522V,
=-0.1522V,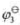 =1.3595V。若按①-❷.❷-❸.①-③方式组成电池,该如何组合?并计算各电池的电动势。
=1.3595V。若按①-❷.❷-❸.①-③方式组成电池,该如何组合?并计算各电池的电动势。
已知下列电对的标准电极电势:
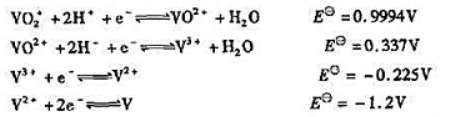
在酸性溶液中分别用1.0mol·L-1Fe2+,1.0mol·L-1Sn2+和Zn还原1.0mol·L-1的VO2+时,最终得到的产物各是什么(不必计算)?
已知




已知在1mol·L-1HC 1介质中,Fe(III)/Fe(II) 电对的Eθ=0.70V.
Sn(Ⅳ)/Sn(Ⅱ)电对的Eθ=0.14V.求在此条件下,反应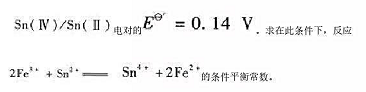 的条件平衡常数。
的条件平衡常数。