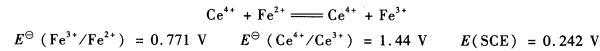题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
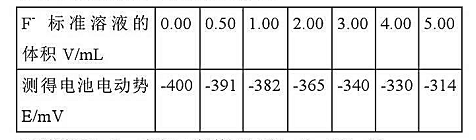
用氟离子选择电极作负极:SCE作正极,取不同体积的含F-标准溶液(CF-=2.0X10-4mol·L卐
用氟离子选择电极作负极:SCE作正极,取不同体积的含F-标准溶液
(CF-=2.0X10-4mol·L-1),加入一定的TISAB,稀释至100mL,进行电位法测定,测得数据如下:
取试液20mL,在相同条件下测定,E=-359mV.
(a)绘制E一–lgCrF-工作曲线.
(b)计算试液中F-的浓度.
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
用氟离子选择电极作负极:SCE作正极,取不同体积的含F-标准溶液
(CF-=2.0X10-4mol·L-1),加入一定的TISAB,稀释至100mL,进行电位法测定,测得数据如下:

取试液20mL,在相同条件下测定,E=-359mV.
(a)绘制E一–lgCrF-工作曲线.
(b)计算试液中F-的浓度.
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“用氟离子选择电极作负极:SCE作正极,取不同体积的含F-标准…”相关的问题
更多“用氟离子选择电极作负极:SCE作正极,取不同体积的含F-标准…”相关的问题
以SCE为正极,选择性电极作负极,放入0.001mol·L-1的F-溶液中时,测得E=-0.159V。当换用了含F-试液后,测得E=-0.212V。计算试液中F的浓度。
用Cl-选择性电极作负极,饱和甘汞电极作正极组成电池测定某溶液中氯化物含量。取100mL此溶液在25℃时测得电池电动势为28.8mV。加入1.00mL浓度为0.475mol·L-1的经酸化的NaCl标准溶液后,测得电池电动势为53.5mV。求该溶液中氯化物浓度。
用标准甘汞电极作正极,氢电极作负极(pH2=100kPa)与待测的HCl溶液组成电池。在25℃时,测得E=0.342V。当待测溶液为NaOH溶液时,测得E=1.050V。取此NaOH溶液20.00mL,用上述HCl溶液中和完全,需用HCl溶液多少毫升?
称取2.000 g一元酸HA(相对分子质量为120)溶于50.00 mL水中,用0.200 0 mol.L-1NaOH溶液滴定,用标准甘汞电极(NCE)作正极,氢电极作负极,当酸被中和一半时,在30℃下测得E=0.583 V,完全中和时,E=0.823 V,计算试样中HA的质量分数。(30℃时RT/F=0.060)
 =0.82V。假设滴定过程中体积不变,求该有机酸的摩尔质量。
=0.82V。假设滴定过程中体积不变,求该有机酸的摩尔质量。
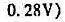
将0.1675g铁配制成100.00mLFeSO4溶液,用0.1000mol·L-1Ce(SO4)2标准溶液滴定。铂电极作指示电极,SCE电极作参比电极,当加入20.00mLCe(SO4)2标准溶液时,电池的电动势是多少?化学计量点的电动势是多少?
Ce4++Fe2+=Ce4++Fe3+E (Fe3+/Fe2+)=0.771
(Fe3+/Fe2+)=0.771
E (Ce4+/Ce3+)=1.44 V E(SCE)=0.242
(Ce4+/Ce3+)=1.44 V E(SCE)=0.242
称取土壤样品6.00g,用pH=7的1mol·dm-3醋酸铵提取,离心,转移含钙的澄清液于100cm3容量瓶中,并稀释至刻度。取50.00cm3该溶液在25℃时用钙离子选择性电极和SCE电极测得电动势为20.0mV,加入0.0100mol·dm-3的标准钙溶液1.0cm3,测得电动势为32.0mV,电极实测斜率为29.0mV,计算土壤样品中Ca2+的质量分数。
将0.167 5 g铁配制成100.00mL FeS04溶液,用0.100 0 mol. L -1 Ce(S04)2标准溶液滴定。铂电极作指示电极,SCE电极作参比电极,当加入20.00 mL Ce(SO4):标准溶液时,电池的电动势是多少?化学计量点的电动势是多少?