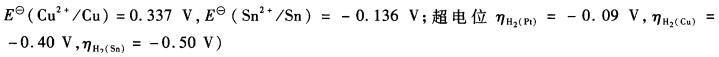题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知ϕθ(Cu2+/Cu+)=0.153V,ϕθ(I2/I-)=0.536V.(1)计算ϕθ
已知ϕθ(Cu2+/Cu+)=0.153V,ϕθ(I2/I-)=0.536V.
(1)计算ϕθ(Cu2+/CuI)的值.
(2)计算当c(Cu2+)=0.50mol·L-1,c(I-)=0.10mol·L-1时,反应2Cu2++4I-=2Cul+I2的标准平衡常数Kθ.
(3)判断在条件(2)下该反应的自发进行方向.[已知Kspθ(CuI)=1.27X10-12]
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案


 更多“已知ϕθ(Cu2+/Cu+)=0.153V,ϕθ(I2/I-…”相关的问题
更多“已知ϕθ(Cu2+/Cu+)=0.153V,ϕθ(I2/I-…”相关的问题
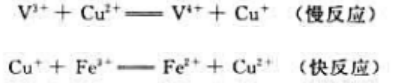
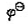 (Cu+/Cu)=0.52V,CuCl的
(Cu+/Cu)=0.52V,CuCl的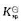 =1.7X10-7。求电极反应CuCl+e-=Cu+CI-的标准电极电势。
=1.7X10-7。求电极反应CuCl+e-=Cu+CI-的标准电极电势。 (Cu2+/Cu)=+0.337V。
(Cu2+/Cu)=+0.337V。
 (Zn2+/Zn)=-0.763V,
(Zn2+/Zn)=-0.763V,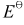 (Cu2+/Cu)=0.337V。
(Cu2+/Cu)=0.337V。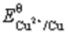 (Cu2+/Cu)=0.337V,
(Cu2+/Cu)=0.337V,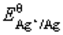 (Ag+/Ag)=0.80V。(提示:首先计算出反应平衡常数。)
(Ag+/Ag)=0.80V。(提示:首先计算出反应平衡常数。) =8.0×10-16,
=8.0×10-16, =2.6×10-19,
=2.6×10-19, =4.6×10-33,
=4.6×10-33, =1.9×10-13。
=1.9×10-13。