 更多“在Bi3+和Ni2+均为0.01mol/L的混合溶液中,如何…”相关的问题
更多“在Bi3+和Ni2+均为0.01mol/L的混合溶液中,如何…”相关的问题
在Bi3+和Ni2+均为0.02mol/L时的混合溶液中,试求以EDTA溶液滴定时所允许的最小pH。能否采用控制溶液酸度的方法实现二者的分别滴定?
当试液中Bi3+、Pb2+的浓度各为0.01mol/L,欲用EDTA标准溶液连续滴定Bi3+、Pb2+时,试选择滴定的酸度条件。
A.不可能将Cu2+与Mg2+分离
B.分离很不完全
C.可完全分离
D.无法判断
用电解方法分离浓度均为8.00×10-2mol?L -1 Zn2+和Ni2+的混合溶液。试问 (1)哪一离子先析出?阴极电位应维持在什么范围内,才可能使这两金属离子分离[vs.SHE(与标准氢电极相比)]? (2)要达到定量分离,阴极电位应维持在什么范围(vs.SHE)?(已知
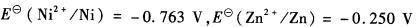 )
)
金属离子Fe2+、Cu2+、Al3+、Mn2+浓度均为0.01mol/L,计算各离子开始沉淀为氢氧化物和沉淀完全的pH。已知 =8.0×10-16,
=8.0×10-16, =2.6×10-19,
=2.6×10-19, =4.6×10-33,
=4.6×10-33, =1.9×10-13。
=1.9×10-13。
含有Cl-、Br-、I-三种离子的混合溶液中,已知其浓度均为0.01mol·L-1,而AgCl、AgBr、AgI的Ksp分别为1.8×10-10、5.0×10-13、8.3×10-17。若向混合溶液中逐滴加入AgNO3溶液,首先析出沉淀的是______,最后析出沉淀的是______。
用控制电位法分离Pb2+和Ni2+混合溶液中的Pb2+,试求: (1)若起始浓度[Pb2+]=[Ni2+]=0.100 0 mol?L-1,要使Pb2+沉积析出,阴极电位应控制在什么范围(vs.SHE)? (2)在(1)中所选定的电位上,计算残留在溶液中未被电解的Pb2+的分数为多少? (3)在(1)中所选定的电位上,要使30 mL混合试样中的Pb2+完全沉积析出,需要通入电量为多少库仑?
A.4.5×10-22;
B.2.1 8×10-17;
C.4.58×10-16:
D.4.58×1022。

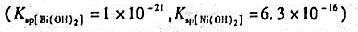

 如果结果不匹配,请
如果结果不匹配,请 
 (cuI),求其在纯水和0.01mol·dm-3KI中的溶解度。
(cuI),求其在纯水和0.01mol·dm-3KI中的溶解度。

















