 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
3.45g H2(g)放在10dm3的密闭容器中,从273K加热到373K,需提供多少能量?H2(g)的根均方速率是原来的多少倍?已
3.45g H2(g)放在10dm3的密闭容器中,从273K加热到373K,需提供多少能量?H2(g)的根均方速率是原来的多少倍?已知H2(g)的摩尔等容热容CV,m=2.5R。
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
3.45g H2(g)放在10dm3的密闭容器中,从273K加热到373K,需提供多少能量?H2(g)的根均方速率是原来的多少倍?已知H2(g)的摩尔等容热容CV,m=2.5R。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“3.45g H2(g)放在10dm3的密闭容器中,从273K…”相关的问题
更多“3.45g H2(g)放在10dm3的密闭容器中,从273K…”相关的问题
1mol理想气体H2(g)由202.65kPa、10dm3定容升温,使压力升高到2026.5kPa,再定压压缩至体积为1dm3。求整个过程的W、Q、△U及△H。
银可能受到H2S(g)的腐蚀而发生如下副反应:
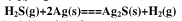
现在298K和标准压力下,将银放在等体积H2和H2S的组成的混合气中。
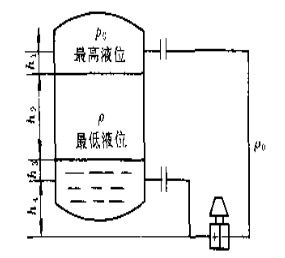
管内的硅油密度ρ0=950kg/m3,h1=40㎝,h2=300㎝,h3=40㎝,h4=60㎝。
试求:(1)差压变送器的量程。
(2)是否需要迁移,迁移量是多少?(g=10m/s2)
A.CO2(g)+CaO(s)→CaCO3(S)
B.1/2H2(g)+1/2I2(g)→HI(g)
C.H2(g)+Cl2(g)→2HCl(g)
D.H2(g)+1/2O2(g)→H20(g)
A.K1+K2
B.K1-K2
C.K1?K2
D.K1/K2
已知同一温度,两反应方程及标准平衡常数如下:
(1) C(石墨)+H2O(g)===CO(g)+H2(g)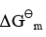
(2) C(石墨)+2H2O(g)===CO2(g)+2H2(g)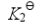
求反应CO(g)+H2O(g)===CO2(g)+H2(g)的KΘ。