 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
根据电极电势计算反应的平衡常数: O2+4Co(NH3)62++2H2O4Co(NH3)63++4OH- (2)现将空
根据电极电势计算反应的平衡常数: O2+4Co(NH3)62++2H2O
 4Co(NH3)63++4OH- (2)现将空气[p(O2)=20.3kPa]通入到含有0.10mol.dm-3Co(NH3)63+、0.10 mol.dm-3Co(NH3)62+、2.0mol.dm-3NH4+和2.0mol.dm-3NH3.H2O的混合溶液中,能否发生上述反应?
4Co(NH3)63++4OH- (2)现将空气[p(O2)=20.3kPa]通入到含有0.10mol.dm-3Co(NH3)63+、0.10 mol.dm-3Co(NH3)62+、2.0mol.dm-3NH4+和2.0mol.dm-3NH3.H2O的混合溶液中,能否发生上述反应?
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案


 更多“根据电极电势计算反应的平衡常数: O2+4Co(NH3)62…”相关的问题
更多“根据电极电势计算反应的平衡常数: O2+4Co(NH3)62…”相关的问题
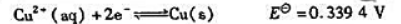
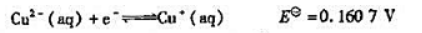
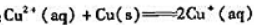 的KΘ;
的KΘ;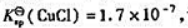 计算反应:
计算反应: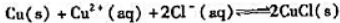 的标准平衡常数KΘ:
的标准平衡常数KΘ: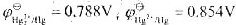 ,试计算(1)反应Hg2++e→1/2Hg22+的标准电极电势。(2)为反应Hg+Hg2+→Hg2-设计电池,并计算该反应的标准平衡常数。
,试计算(1)反应Hg2++e→1/2Hg22+的标准电极电势。(2)为反应Hg+Hg2+→Hg2-设计电池,并计算该反应的标准平衡常数。
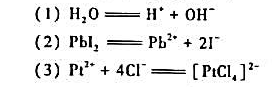
 的标准平衡常敷,说明反应能否正向进行.
的标准平衡常敷,说明反应能否正向进行.
















