 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
计算一元弱酸溶液的c(H+),常用的最简式为c(H+)=______,使用此式时要先检查是否满足两个条件:______和______
计算一元弱酸溶液的c(H+),常用的最简式为c(H+)=______,使用此式时要先检查是否满足两个条件:______和______,否则将引入较大误差。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
计算一元弱酸溶液的c(H+),常用的最简式为c(H+)=______,使用此式时要先检查是否满足两个条件:______和______,否则将引入较大误差。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“计算一元弱酸溶液的c(H+),常用的最简式为c(H+)=__…”相关的问题
更多“计算一元弱酸溶液的c(H+),常用的最简式为c(H+)=__…”相关的问题
计算一元弱碱溶液的c(OH-)值,常用的最简式为c(OH-)=______,使用此式时应先满足两个条件,即______和______。
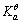 值。
值。
使用最简式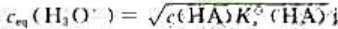 计算元弱酸HA溶液中,H3O+浓度,需要满足的两个条件是()和()。
计算元弱酸HA溶液中,H3O+浓度,需要满足的两个条件是()和()。
A.NaHCO3中含有氢,故其水溶液呈酸性
B.浓HAc(17mol/L)的酸度大于17mol/L H2SO4水溶液的酸度
C.浓度(单位:mol/L)相等的一元酸和一元碱反应后,其溶液呈中性
D.弱酸溶液愈稀,其电离度愈大,因而酸度亦愈大
E.当[H+]大于[OH-]时,溶液呈酸性
A.NaHCO3中含有氧,故其水溶液呈酸性
B.浓HAc(17mol/L)的酸度大于1mol/L H2SO4水溶液的酸度
C.浓度(单位:mol/L)相等的一元酸和一元碱反应后,其溶液呈中性
D.弱酸溶液愈稀,其电离度愈大,因而酸度亦愈大
E.当c(H+)大于c(OH-)时,溶液呈酸性
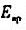 =0.82V。假设滴定过程中体积不变,求该有机酸的摩尔质量。
=0.82V。假设滴定过程中体积不变,求该有机酸的摩尔质量。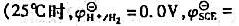
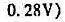
有一弱酸HA,其离解常数Ka=6.4×10-7,计算c(HA)=0.30mol·L-1时溶液的c(H+)。
25℃时,一元弱酸HA的标准解离常数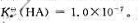 试计算0.10mol·L-1HA溶液的pH和HA的解离度。
试计算0.10mol·L-1HA溶液的pH和HA的解离度。
用0.1000mol·L-1NaOH溶液滴定50.00mL一元弱酸的数据如下:
(a)绘制滴定曲线;
(b)绘制 曲线;
曲线;
(c)用二级微商法确定终点;
(d)计算试样中弱酸的浓度;
(e)化学计量点的PH应为多少?
(f)计算此弱酸的电离常数(提示:根据滴定曲线上的半中和点的PH)。
| 体积/mL | pH |
| 0.00 1.00 2.00 4.00 7.00 10.00 12.00 14.00 15.00 15.50 15.60 15.70 15.80 16.00 17.00 20.00 24.00 28.00 | 3.40 4.00 4.50 5.05 5.47 5.85 6.11 6.60 7.04 7.70 8.24 9.43 10.03 10.61 11.30 11.96 12.39 12.57 |